Inhalační glukokortikosteroidy pro léčbu bronchiálního astmatu.
Obsah [Zobrazit obsah]
Inhalační glukokortikosteroidy pro léčbu bronchiálního astmatu
Využití hormonů v léčbě astmatu: účinnost, vedlejší účinky

Bronchiální astma je chronické onemocnění dýchacího systému, při kterém dochází k závažnému zúžení průdušek. Hormony u astmatu jsou potřebné k zajištění protizánětlivého a antialergického účinku.
Základní léčba astmatu zahrnuje glukokortikosteroidy. Pokud se nepoužívají k léčbě onemocnění, závislost na symptomatických bronchodilatanciích se značně zvyšuje. To je známka nekontrolovaného astmatu.
Co jsou glukokortikosteroidy

Glukokortikosteroidy jsou hormony produkované kůrou nadledvin. Lidské tělo produkuje kortizol a kortikosteron.
Všestranné působení těchto biologicky aktivních látek na organismus umožnilo jejich aktivní využití při léčbě různých onemocnění včetně astmatu.
Nyní existuje řada fluorovaných i nefluorovaných syntetických glukokortikoidů. Na rozdíl od přírodních mají větší aktivitu, a proto působí efektivněji.
Mechanismus působení GCS
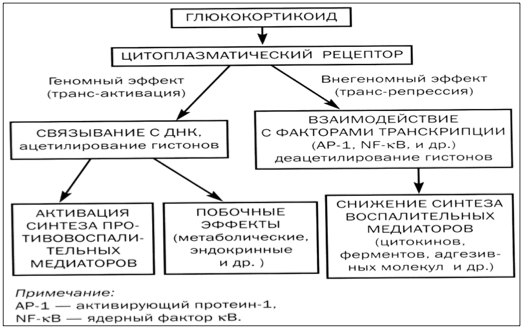
Abychom plně pochopili, proč jsou hormony astmatu tak aktivně používány, je důležité znát jejich mechanismus účinku. V buňkách lidského těla existují speciální receptory, se kterými se váží glukokortikosteroidy a pronikají do cytoplazmy.
Komplex získaný v důsledku této interakce proniká do jádra, kde působí přímo na DNA. To vám umožní aktivovat proces tvorby různých proteinů:
- lipokortin-1. Jeho působení je zaměřeno na inhibici produkce kyseliny arachidonové, ze které jsou syntetizovány zánětlivé mediátory;
- neutrální endopeptidáza. Potřebné ke zničení kininových komplexů zapojených do vývoje zánětlivého procesu;
- interleukin-10, který má protizánětlivý účinek;
- inhibitor jaderného faktoru. Hraje důležitou roli při inhibici zánětlivého procesu průdušek.
V důsledku působení komplexu hormon-receptor je pozorována výrazná inhibice tvorby proteinů, které aktivují zánětlivý proces.
Díky svým vlastnostem jsou glukokortikoidy vynikající pro léčbu bronchiálního astmatu, mají výrazný protizánětlivý účinek.
Použití glukokortikosteroidů při léčbě astmatu
Použití glukokortikoidů u bronchiálního astmatu je tradiční metodou léčby tohoto onemocnění. Jejich používání začalo v polovině 40. let dvacátého století poté, co F. Hench a E. Kendall uměle syntetizovat GCS.
Když si uvědomili, že glukokortikosteroidy pomáhají kontrolovat zánětlivý proces u hormonálního astmatu, začali je aktivně testovat při léčbě onemocnění, ale zaznamenali velké množství vedlejších účinků a dočasně přestali používat.
V moderní medicíně jsou astmatikům předepisovány dva typy hormonálních léků: inhalační a systémové kortikosteroidy.
Inhalační kortikosteroidy

Hlavní výhody, které vysvětlují široké použití inhalačních glukokortikosteroidů (ICS) k léčbě bronchiálního astmatu, jsou vysoká lipofilita, krátký poločas a rychlá inaktivace.
V klinické praxi se používají následující IKS:
- beklomethason dipropionát;
- budesonid;
- mometason furoát;
- flutikason propionát;
- ciclesonid.
Mechanismus účinku IKS u bronchiálního astmatu je založen na jejich vysoké lipofilitě. Epitel lidských průdušek je pokryt slabou vrstvou tekutiny.
Proto ne všechny látky mohou rychle proniknout touto bariérou. Lipofilita umožňuje léku rychle dosáhnout bronchiální sliznice a proniknout do oběhového systému.
Účinek užívání inhalačních glukokortikoidů přímo závisí na způsobu, jakým byly do těla dodány.
Při použití aerosolových inhalátorů se tedy většina léčiva usazuje v dutině ústní nebo je spolknuta. Pouze 10 % zasahuje přímo do bronchiální sliznice.
Při vdechování léku přes spacer – asi 5%. IKS se dostávají do systémové cirkulace ve formě neaktivních metabolických produktů, s výjimkou beklometazonu. Podávání léků pomocí rozprašovače se také používá pro určité skupiny pacientů, a to:
- děti;
- starší lidé
- lidé s poruchou vědomí;
- pacientů s těžkou bronchiální obstrukcí.
Podle řady klinických studií jsou inhalační glukokortikosteroidy extrémně účinné u bronchiálního astmatu.
Systémové glukokortikoidy

Systémové glukokortikosteroidy (SGC) nejsou nouzovými léky pro bronchiální astma, ale jsou extrémně důležité pro terapeutická opatření během exacerbací. Obecně jsou potřebné ke zlepšení kvality života pacienta a nemají rychlý účinek.
Podle globální strategie WHO je extrémně důležité používat GCS u všech exacerbací astmatu kromě nejlehčích. To platí zejména pro následující případy:
- po podání IKS nedochází ke zlepšení stavu pacienta;
- útok začal navzdory užívání IKS;
- je nutné zvýšit dávku IKS;
- stav pacienta se neustále zhoršuje;
- snížená reakce těla na působení IKS;
- pokles ukazatelů špičkového průtoku (PSF pod 60 %)
Je třeba poznamenat, že pro dlouhodobou terapii je lepší používat SGCS ve formě tablet, častěji se používá při záchvatu. Hlavními glukokortikosteroidy používanými k systémové léčbě bronchiálního astmatu jsou prednisolon a hydrokortison.
Při perorálním podání je pozorována extrémně vysoká biologická dostupnost. Maximální koncentrace léčiva v krvi při intravenózním podání je dosaženo méně než hodinu po vstupu do těla.
V játrech jsou tyto léky metabolizovány a poté vylučovány močí.
Nežádoucí účinky glukokortikosteroidů

Při léčbě pacientů s hormonálně závislým bronchiálním astmatem je důležité si uvědomit, že GCS má řadu vedlejších účinků, které lze rozdělit do dvou skupin:
- Nemoci vznikající během terapie.
- Rozvíjející se po ukončení léčby (abstinenční syndrom).
První skupina zahrnuje následující důsledky:
- metabolické poruchy;
- zvýšený krevní tlak;
- snížený imunitní stav;
- peptický vřed;
- myopatie;
- duševní poruchy;
- poruchy růstu u dětí;
- Cushingoid.
Metabolické poruchy se projevují ve formě hyperglykémie, poruch tuků, ale i metabolismu vody a elektrolytů. Zvýšení hladiny krevního cukru je způsobeno tím, že při užívání GCS dochází ke zvýšení odolnosti tkání vůči působení inzulínu.
Tento stav je však pozorován poměrně zřídka a lidé, kteří mají kromě hormonálního astmatu diabetes mellitus, jsou k němu náchylnější.
Porucha metabolismu tuků se projevuje tím, že na obličeji a trupu dochází k nadměrnému rozvoji tukové tkáně. Vzniká tzv. cushingoidní habitus.
Poruchy metabolismu vody a minerálů se projevují zadržováním vody v těle a ztrátou vápníku a draslíku.
Arteriální hypertenze při užívání GCS je spojena s jejich účinkem na stěny krevních cév. Vyvíjí se při dlouhodobé léčbě velkými dávkami léků.
Ještě méně častá je vředová choroba. Proto by všichni pacienti, kteří používají SGCS v léčbě astmatu, měli být vyšetřeni na přítomnost vředů v žaludku.
U některých pacientů užívajících GCS se může objevit svalová slabost, dokonce úplná atrofie. To přímo souvisí s účinkem léků na metabolismus minerálů. Také u Cushingoidu lze pozorovat myopatii, takže ji nelze nazvat specifickým vedlejším účinkem.
Při velmi časném zahájení terapie GCS lze pozorovat mírné poruchy duševního stavu. Pacienti tak pociťují nervozitu, časté změny nálad a poruchy spánku. Steroidní psychózy se vyvíjejí extrémně vzácně.
U dětí může při použití SCS dojít k poruchám růstu. Zvláště náchylní jsou na to chlapci. Předpokládá se, že patologie je spojena s porušením produkce pohlavních hormonů.
Abstinenční syndrom zahrnuje zvýšenou únavu, nedostatek chuti k jídlu, horečku, nevolnost a silné bolesti hlavy. V některých případech může dojít k insuficienci nadledvin. Klinický obraz pseudotumor cerebri je extrémně vzácný.
Je možné astma léčit bez použití hormonů?

První věc, kterou by lidé s hormonálně závislým bronchiálním astmatem měli pochopit, je, že nemohou nezávisle odmítnout použití GCS. Léčba by měla být systémová a pod dohledem specialisty.
Pokud mluvíme o léčbě astmatu bez hormonálních léků, pak si musíme vzpomenout na skupinu léků, jako jsou kromony. Musíte pochopit, že tyto léky mají spíše preventivní než léčebný účinek.
Doporučují se používat během remise. Existuje mnoho forem kromonů, ale nejlepšího účinku se dosáhne při použití s inhalátory. Mají řadu výhod:
- snadnost použití;
- nedostatek závislosti;
- minimální riziko nežádoucích účinků.
Přípravky kyseliny kromoglykové jsou pro své vlastnosti vynikající pro prevenci astmatických záchvatů u dětí trpících lehkou formou onemocnění. V souladu s globální strategií WHO jsou lékem první volby.
Pokud podle studií u středně těžkého až těžkého astmatu nevyvolává použití inhalačních kortikosteroidů žádné otázky, pak v počátečních fázích není jejich použití opodstatněné.
Léčba astmatu bez hormonů u dospělého, který již dlouhodobě užíval steroidy, je téměř nemožná.
Konečně,
Při léčbě bronchiálního astmatu je důležité používat léky jako IKS a SGCS pod dohledem lékaře. Léky musí být vybírány individuálně a samotná léčba musí být systémové povahy.
Při exacerbacích astmatu se doporučuje použít IKS k úlevě od záchvatu a poté případně přidat SGCS. Navzdory riziku nežádoucích účinků jsou tyto léky nejlepší možností pro léčbu astmatu.
Lokální léčba bronchiálního astmatu: inhalátory, základní terapie, léky a nelékové metody
Bronchiální astma je onemocnění dýchacích cest, neustále progredující a zpravidla se rozvíjející v dětství vlivem různých faktorů alergické, infekční a genetické povahy. To určuje význam preventivních metod a potřebu léčby bronchiálního astmatu u dospělých a dětí.
Základní kroková terapie u dospělých
Léčba astmatu je založena a závisí na úrovni kontroly onemocnění, nikoli na jeho závažnosti, která se může v průběhu času vlivem terapie měnit. Kontrola onemocnění se skládá ze dvou složek: kontroly symptomů a minimalizace rizik exacerbace. U pacientů s různou úrovní kontroly onemocnění je však závažnost vodítkem při předepisování základní terapie bronchiálního astmatu.
Základní terapie je nezbytná pro snížení počtu exacerbací a hospitalizací pacientů v důsledku nekontrolovaného bronchiálního astmatu.
Objem základní terapie je stanoven individuálně a má postupný přístup. Existuje 5 stupňů léčby bronchiálního astmatu. Každá fáze má preferovanou možnost terapie a alternativní metody.
Jak léčit doma
Léčba astmatu doma u dospělých je možná při plném dodržování léčebného režimu. Jak léčit toto onemocnění u dospělých je určeno lékařským předpisem. Neúčinnost léčby v tomto případě může být způsobena nedostatkem techniky pro použití astmatického inhalátoru. To je vysvětleno skutečností, že lék na bronchiální astma nevstupuje do dýchacího traktu a není schopen poskytnout potřebný terapeutický účinek.
Při zhoršení příznaků a zhoršení stavu pacienta při domácí léčbě je nutná konzultace s lékařem, který zhodnotí průběh onemocnění a předepíše účinnou terapii.
Přehled léků
K léčbě bronchiálního astmatu se používá široká škála léků. Jejich kombinace a dávky volí lékař s ohledem na dynamiku onemocnění a stav pacienta.
Použití IKS ve formě inhalátorů (sprejů)
Inhalační glukokortikosteroidy (IKS) jsou nejúčinnějšími léky v základní léčbě bronchiálního astmatu. IKS může snížit závažnost symptomů, zlepšit vnější dýchání a minimalizovat jevy bronchiální hyperreaktivity.
V klinické praxi jsou široce používány následující léky:
Mechanismus účinku glukokortikoidů u bronchiálního astmatu je založen na jejich protizánětlivém účinku. Pomocí inhalátorů používaných při bronchiálním astmatu se molekuly glukokortikosteroidů objevují na epitelu dýchacích cest. Poté proniknou membránou a skončí v oblasti, kde dochází k reakcím, které stimulují uvolňování protizánětlivých molekul.
Názvy některých inhalátorů používaných pro astma:
Klinického účinku glukokortikosteroidů je dosaženo podáváním různých dávek a závisí na stupni onemocnění. Nízké dávky IKS snižují četnost exacerbací, zlepšují zevní dýchání, snižují zánět a hyperreaktivitu dýchacích cest. Ke snížení bronchiální hyperreaktivity a lepší kontrole průběhu onemocnění se používají vysoké dávky IKS.
Antileukotrien
Antileukotrienová léčiva pro léčbu bronchiálního astmatu inhibují cysteinylové leukotrienové receptory v eosinofilech a neutrofilech. To určuje jejich protizánětlivý účinek. Mají také bronchodilatační účinek. Tato skupina léků našla zvláště široké použití u aspirinem indukovaného bronchiálního astmatu a polypózní rinosinusitidy.
Užívání antileukotrienových léků na bronchiální astma pomáhá snížit předepsané dávky inhalačních glukokortikosteroidů.
Bronchodilatancia (Eufillin a další)
Bronchodilatátory pro bronchiální astma jsou široce používány k odstranění bronchospasmu. Bronchodilatační léky jsou dostupné ve formě inhalátorů, sprejů, sirupů, roztoků a tablet na bronchiální astma.
Farmakologické skupiny, které mají bronchodilatační účinek, zahrnují:
· agonisté beta-2 adrenergních receptorů, kteří se dělí na krátkodobě a dlouhodobě působící agonisty (formoterol a salmeterol);
Při tomto onemocnění se aktivně využívá i Eufillin, inhibitor fosfodiesterázy, uvolňuje svaly průdušek, uvolňuje bronchospasmus, působí stimulačně na kontrakci bránice a dýchacího centra. Navíc použití aminofylinu vede k normalizaci respiračních funkcí a saturaci krve kyslíkem.
Není možné vybrat nejlepší tablety pro léčbu bronchiálního astmatu, seznam léků sestavuje lékař na základě aktuálního stavu nemocného.
Glukokortikoidy (prednisolon a další)
Prednisolon se aktivně používá ve skupině glukokortikoidů. Nemá bronchodilatační účinek, ale působí silně protizánětlivě. Glukokortikoidy se předepisují při záchvatech, při kterých je bronchodilatační léčba neúčinná. Účinek prednisolonu nenastává okamžitě – rozvíjí se do 6 hodin po užití léku.
Dávka prednisolonu je až 40 mg denně. Jeho snížení by mělo probíhat postupně, protože jinak bude riziko exacerbací vysoké.
kromoni
Kromony jsou léky používané při bronchiálním astmatu a mají protizánětlivý účinek. Tato skupina léků našla širší využití v pediatrické praxi díky své bezpečnosti a minimálním vedlejším účinkům. Kromony se používají ve formě inhalací a sprejů na bronchiální astma. V případě broncho-obstrukčního syndromu se před použitím doporučuje předepsat krátkodobě působící beta-2 agonisty.
Kašel u astmatu se vyskytuje na pozadí exspirační dušnosti a je zmírněn společně s bronchiálním spasmem pomocí léků diskutovaných výše. Kašel, který není spojen s atakou, by měl být léčen na základě své povahy antibiotiky, mukolytiky, antitusiky a dalšími léky.
Seznam nejúčinnějších léků
Níže je uveden seznam nejúčinnějších léků na bronchiální astma:
1. Omalizumab je lék reprezentovaný monoklonálními protilátkami. Je schopen zajistit léčbu astmatu bez hormonů i v těžkých případech onemocnění u dospělých. Užívání omalizumabu může úspěšně kontrolovat příznaky bronchiálního astmatu.
2. Zafirlukast je lék, který má protizánětlivé a bronchodilatační účinky. Mechanismus účinku přípravku Zafirlukast je založen na blokování leukotrienových receptorů a prevenci bronchiálních kontrakcí. Hlavní indikace k použití: mírné až středně těžké astma.
3. Budesonid je glukokortikosteroid, který má protizánětlivý antialergický účinek. Budesonid pro astma se používá v inhalační formě.
4. Atrovent (ipratropium bromid) je inhalační anticholinergikum, které má bronchodilatační účinek. Mechanismus účinku je založen na inhibici svalových receptorů tracheobronchiálního stromu a potlačení reflexní bronchokonstrikce.
U bronchiálního astmatu mohou pacienti bez potvrzené invalidity počítat s léky zdarma. Podmínky pro jejich poskytování se v čase mění, závisí také na regionu bydliště, proto je třeba otázku jejich získání směřovat na lékaře.
Nedrogové metody
Nemedikamentózní léčba bronchiálního astmatu působí jako doplněk k hlavní léčbě a zpravidla ji předepisuje ošetřující lékař, pokud je indikován. Postupy jsou vybírány individuálně a podle doporučení specialisty.
masáž
Masáž při bronchiálním astmatu pomáhá zlepšit krevní oběh, aktivuje dýchací svaly a zvyšuje nasycení tkání kyslíkem. Masáž také pomáhá odstranit překrvení plic a zlepšit průchodnost dýchacích cest při obstrukčním syndromu.
Během interiktálních období se doporučují masáže. Jako každá metoda má však masáž kontraindikace.
fyzioterapie
Fyzioterapie u bronchiálního astmatu je reprezentována různými metodami, které se liší v závislosti na období onemocnění. Například během exacerbace astmatu lze aerosolovou terapii provádět pomocí ultrazvuku. Kromě toho se používá také elektroaerosolová terapie.
Aerosolové inhalace se provádějí s aminofylinem, heparinem, propolisem, atropinem.
Za účelem obnovení průchodnosti průdušek se používá elektroforéza bronchodilatancií na mezilopatkové oblasti.
Mezi nespecifické metody patří ultrafialové ozařování pro zvýšení odolnosti imunitního systému organismu.
Během interiktálního období se používá elektroforéza vápenatých iontů a také fonoforéza hydrokortizonu na segmentálních zónách hrudníku.
V léčbě průduškového astmatu se dosud osvědčila magnetoterapie a nízkofrekvenční ultrazvuk.
Léčba sanatorií
Sanatorní léčba bronchiálního astmatu je kombinací klimatické terapie, thalassoterapie a balneoterapie. Sanatoria se nacházejí na Krymu, Kislovodsku, Gorném Altaji a jsou oblíbená mezi pacienty s onemocněním dýchacích cest. Rehabilitace v takových centrech je poskytována pouze těm pacientům, kteří jsou ve fázi stabilní remise, a těm, kteří prošli důkladným vyšetřením.
Je však třeba vzít v úvahu skutečnost, že pacient potřebuje čas na přizpůsobení se klimatickým podmínkám, proto by měl lékař při výběru sanatoria upřednostňovat střediska s klimatem blízkým tomu, ve kterém je pacient zvyklý žít.
Lidové prostředky
Použití lidových prostředků není zvlášť účinné a má jen minimální účinek. Bylinná medicína je považována za nejúčinnější lidový lék na léčbu bronchiálního astmatu. Jedná se o použití léčivých rostlin ve formě inhalací a tabletových forem.
· česneková šťáva může být použita pro aerosolové inhalace;
· čaj z bobulí a brusinkových listů;
· odvar z plodů kaliny a medu.
Bylinná medicína má řadu vedlejších účinků (alergické reakce) a kontraindikace, což vyžaduje povinnou konzultaci s odborníkem před použitím.
Dechová cvičení
Dechová cvičení patří do fyzikální terapie a zahrnují provádění cvičení doprovázených zadržením dechu.
Účelem této metody je zmírnit a zabránit záchvatu bronchiálního astmatu.
Dieta
Dieta pro bronchiální astma se příliš neliší od stravy zdravého člověka. Lékaři však doporučují při sestavování jídelníčku dodržovat určité zásady:
1. Omezte denní příjem soli.
2. Pijte dostatečné množství tekutin denně (alespoň 1,5 litru).
3. Omezte konzumaci tučných, smažených a kořeněných jídel.
4. Přednost se dává pokrmům dušeným a vařeným.
5. Doporučuje se jíst malá jídla mnohokrát denně (5-6krát).
6. Výživa by měla být vyvážená v bílkovinách, tucích a sacharidech.
7. Jídelníček by měl obsahovat jak zeleninu a ovoce, tak maso a ryby.
Pomoc při záchvatu
Status astmaticus je stav charakterizovaný prodlouženým záchvatem astmatu, který není zmírněn bronchodilatátory během několika hodin. Aby bylo možné v tomto případě léčit bronchiální astma, je důležité si uvědomit, že cílem pomoci poskytované během exacerbace bronchiálního astmatu je omezit působení spouštěče a zmírnit záchvat dušení.
Léky používané k léčbě záchvatu bronchiálního astmatu u dospělých se s výhodou používají ve formě inhalací nebo infuzí.
Bronchodilatační terapii během záchvatu představují rychle působící beta-2 agonisté. Poté se po hodině sleduje stav pacienta, a pokud se symptomy zmírní, pokračuje se v užívání beta-2 agonisty každé 3 hodiny po dobu 2 hodin nebo XNUMX dnů.
V případě střední závažnosti zvyšte dávku inhalačních kortikosteroidů, přidejte jejich perorální formy, inhalační anticholinergikum a pokračujte v léčbě beta-2 agonisty také každé 3 hodiny po dobu 1-2 dnů.
V těžkých případech se ve vyšších dávkách přidávají i perorální a inhalační formy glukokortikosteroidů. Je indikována hospitalizace na lůžkovém oddělení.
V případě astmatického stavu je pacient urgentně hospitalizován na jednotce intenzivní péče a je zahájena okamžitá intenzivní péče:
1. Systémové glukokortikosteroidy (prednisolon) se aplikují ihned intravenózně, inhalační pomocí nebulizéru.
2. Epinefrin (adrenalin) se podává subkutánně nebo intramuskulárně při hrozbě zástavy dechu.
3. Umělá ventilace a resuscitační opatření se provádějí, pokud existují klinické indikace pro tyto postupy.
Dá se tato nemoc vyléčit?
Bronchiální astma je onemocnění dýchacích cest, které nelze zcela vyléčit. Ke zmírnění příznaků se používají léky na astma.
Možnosti moderní medicíny jsou limitovány schopností minimalizovat rizikové faktory, zmírňovat symptomy a zlepšovat kvalitu zdraví a života pacienta.
Preventivní metody jsou zvláště důležité jak u dětí, tak u dospělých. V dětském věku jsou zaměřeny na eliminaci rizikových faktorů a primárního rozvoje astmatu.
Závěr
Bronchiální astma je zánětlivé onemocnění, které má v závislosti na etiologickém faktoru alergickou, infekční a neinfekční genezi.
Léčba bronchiálního astmatu zahrnuje použití léčivých i neléčivých metod.
Závažnost průběhu a klinický obraz onemocnění určuje lékařskou taktiku a potřebné množství terapie pro pacienta.
Pokud se vám článek líbil, dejte like a přihlaste se k odběru kanálu, aby vám neunikl nový materiál!
Informace zveřejněné na kanálu Zen slouží pouze pro informační účely. Určitě se poraďte s odborníkem.
Bronchiální astma u dětí. Klinické pokyny (část 2)
Publikováno v časopise:
„Praktika dětského lékaře“, září 2008, s. 7-18
L.D. Goryachkina, N.I. Ilyina, L.S. Namazová, L.M. Ogorodová, I.V. Sidorenko, G.I. Smirnová, B.A. Chernyak
Hlavním cílem léčby pacientů s bronchiálním astmatem je dosažení a dlouhodobé udržení kontroly onemocnění. Léčba by měla začít zhodnocením současné kontroly astmatu a množství terapie by mělo být pravidelně kontrolováno, aby bylo zajištěno dosažení kontroly.
Léčba bronchiálního astmatu (BA) zahrnuje:
- Eliminační opatření zaměřená na snížení nebo eliminaci vlivu kauzálních alergenů (viz část 1; „Praktika pediatra“, květen 2008).
- Farmakoterapie.
- Alergenová specifická imunoterapie (ASIT).
- Edukace pacientů.
FARMAKOTERAPIE
K léčbě astmatu u dětí se používají léky, které lze rozdělit do dvou velkých skupin:
- Prostředky základní (podpůrné, protizánětlivé) terapie.
- Symptomatická léčba.
К léky základní terapie jsou:
- léky s protizánětlivými a/nebo profylaktickými účinky (glukokortikosteroidy (GCS), antileukotrieny, kromony, anti-IgE léky);
- dlouhodobě působící bronchodilatátory (dlouhodobě působící β2– adrenergní agonisté, teofylinové přípravky s pomalým uvolňováním).
Největší klinická a patogenetická účinnost je prokázána při použití inhalačních kortikosteroidů (ICS). Veškerá základní protizánětlivá terapie se užívá denně a dlouhodobě. Princip pravidelného užívání základních léků umožňuje dosáhnout kontroly nad nemocí. Nutno podotknout, že u nás je pro základní terapii BA u dětí pomocí kombinovaných léků s obsahem IKS (s 12hodinovou přestávkou) registrován pouze stabilní dávkovací režim. Jiné režimy pro použití kombinovaných léků u dětí nejsou povoleny.
К symptomatické prostředky jsou:
- inhalace krátkodobě působící β2– adrenergní agonisté;
- anticholinergní léky;
- Teofylinové přípravky s okamžitým uvolňováním;
- perorálně krátkodobě působící β2– adrenergní agonisté.
Symptomatické léky se také nazývají léky „první pomoci“. Musí být použity k odstranění bronchiální obstrukce a jejích doprovodných akutních příznaků (sípání, tlak na hrudi, kašel). Tento způsob užívání drog se nazývá „na vyžádání“.
TRASY DODÁVKY LÉKŮ
Léky pro léčbu astmatu se podávají různými způsoby: orálně, parenterálně a inhalačně (výhodná je ta druhá). Při výběru zařízení pro inhalaci se bere v úvahu účinnost podávání léku, cena/efektivita, snadnost použití a věk pacienta (tabulka 1). Pro inhalaci u dětí se používají tři typy zařízení: nebulizéry, inhalátory s odměřenou dávkou (MDI) a práškové inhalátory.
Tabulka 1. Vehikula pro podávání léků pro astma (věkové priority)
U dětí se používají následující IKS: beklomethason, flutikason, budesonid. Dávky léků používaných k základní terapii se dělí na nízké, střední a vysoké. Užívání IKS v nízkých dávkách je bezpečné při předepisování vyšších dávek je nutné pamatovat na možnost nežádoucích účinků. Ekvipotentní dávky uvedené v tabulce 2 byly vyvinuty empiricky, proto by při výběru a změně IKS měly být brány v úvahu individuální charakteristiky pacienta (odpověď na terapii).
Tabulka 2. Ekvipotentní denní dávky IKS
Dávky pro děti do 12 let
Dávky pro děti starší 12 let
IKS jsou součástí kombinovaných léků pro léčbu astmatu. Takovými léky jsou Seretide (salmeterol + flutikason propionát) a Symbicort (formoterol + budesonid). Velké množství klinických studií prokázalo, že kombinace dlouhodobě působícího β2-adrenergní agonisté a IKS v nízké dávce jsou účinnější než zvyšování jejich dávky. Kombinovaná léčba salmeterolem + flutikasonem (v jednom inhalátoru) podporuje lepší kontrolu astmatu než dlouhodobě působící β2– adrenomimetika a IKS v samostatných inhalátorech. Při dlouhodobé léčbě salmeterolem + flutikasonem lze dosáhnout úplné kontroly astmatu téměř u každého druhého pacienta (podle studie, která zahrnovala pacienty ve věku 12 let a starší). Dochází také k výraznému zlepšení ukazatelů účinnosti terapie (PSV, FEV1, frekvence exacerbací, kvalita života). Pokud použití nízkých dávek IKS u dětí neumožňuje dosažení kontroly BA, doporučuje se přejít na kombinovanou léčbu, která může být dobrou alternativou ke zvýšení dávky IKS. To bylo prokázáno v nové prospektivní, multicentrické, dvojitě zaslepené, randomizované studii s paralelními skupinami trvající 12 týdnů, která porovnávala účinnost kombinace salmeterol + flutikason (v dávce 50/100 mcg dvakrát denně) a 2krát vyšší dávka flutikasonpropionátu (2 mcg 200krát denně) u 2 dětí ve věku 303–4 let s přetrvávajícími příznaky astmatu navzdory předchozí léčbě nízkými dávkami IKS. Ukázalo se, že pravidelné užívání kombinace salmeterol + flutikason (Seretide) předchází příznakům a dosahuje kontroly astmatu stejně účinně jako dvojnásobná dávka IKS. Léčba přípravkem Seretide je doprovázena výraznějším zlepšením funkce plic a snížením potřeby léků na zmírnění příznaků astmatu s dobrou snášenlivostí: ve skupině léčené přípravkem Seretide je zvýšení ranní PEF o 11 % vyšší a počet dětí s úplná absence potřeby „záchranné terapie“ je o 46 % více než ve skupině s flutikasonem. Léčba pomocí kombinace formoterol + budesonid jako součást jednoho inhalátoru poskytuje lepší kontrolu příznaků astmatu ve srovnání se samotným budesonidem u pacientů, u kterých dříve IKS neposkytovala kontrolu příznaků.
Vliv ICS na růst
Nekontrolované nebo těžké astma zpomaluje růst dětí a snižuje celkovou výšku. Žádná z dlouhodobých kontrolovaných studií neprokázala statisticky nebo klinicky významný vliv na růst ICG terapie v dávce 100-200 mcg/den. Zpomalení lineárního růstu je možné při dlouhodobém podávání jakéhokoli IKS ve vysoké dávce. Děti s astmatem léčené IKS však dosahují normálního růstu, i když někdy později než ostatní děti.
Účinek IKS na kostní tkáň
Žádné studie neprokázaly statisticky významné zvýšení rizika zlomenin kostí u dětí užívajících IKS.
Vliv IKS na systém hypotalamus-hypofýza-nadledviny
Dávka terapie IKS IKS a orální kandidóza
Klinicky významná drozd je vzácná a je pravděpodobně spojena se současnou antibiotickou terapií, užíváním vysokých dávek inhalačních kortikosteroidů a vysokou frekvencí inhalací. Použití spacerů a ústní výplachy snižuje výskyt kandidózy.
Další nežádoucí účinky
Na pozadí pravidelné základní protizánětlivé terapie nedošlo ke zvýšení rizika katarakty a tuberkulózy.
II. Antagonisté leukotrienových receptorů
Antileukotrienová léčiva (zafirlukast, montelukast) poskytují částečnou ochranu proti bronchospasmu vyvolanému námahou po dobu několika hodin po podání. Přidání antileukotrienů k léčbě v případě nedostatečné účinnosti nízkých dávek IKS přináší mírné klinické zlepšení, včetně statisticky významného snížení frekvence exacerbací. Klinická účinnost léčby antileukotrieny byla prokázána u dětí ve věku > 5 let ve všech stupních závažnosti astmatu, ale účinnost těchto léků je obvykle nižší než u nízkých dávek IKS. Antileukotrienová léčiva lze použít k posílení terapie u dětí se středně těžkým astmatem v případech, kdy onemocnění není dostatečně kontrolováno nízkými dávkami IKS. Při použití antagonistů leukotrienových receptorů jako monoterapie u pacientů s těžkým a středně těžkým astmatem je zaznamenáno mírné zlepšení plicních funkcí (u dětí 6 let a starších) a kontroly astmatu (u dětí 2 let a starších). Zafirlukast má střední účinnost ve vztahu k respirační funkci u dětí ve věku 12 let a starších se středně těžkou až těžkou BA A.
III. Cromony
Nedocromil a kyselina kromoglycová jsou méně účinné než IKS ve vztahu ke klinickým symptomům, respiračním funkcím, zátěžovému astmatu a hyperreaktivitě dýchacích cest. Dlouhodobá léčba astmatu kyselinou kromoglycovou u dětí se významně neliší v účinnosti od placeba A. Nedocromil předepsaný před fyzickou aktivitou může snížit závažnost a trvání jím způsobené bronchokonstrikce. Kromony jsou kontraindikovány při exacerbaci astmatu, kdy je nutná intenzivní léčba rychle působícími bronchodilatátory. Role kromonů v základní léčbě astmatu u dětí (zejména předškolních dětí) je omezená pro nedostatek důkazů o jejich účinnosti. Metaanalýza provedená v roce 2000 nám neumožnila učinit jednoznačný závěr o účinnosti kyseliny kromoglycové jako prostředku základní terapie BA u dětí B. Je třeba mít na paměti, že léky z této skupiny nelze použít k počáteční léčbě středně těžkého a těžkého astmatu. Použití kromonů jako základní terapie je možné u pacientů s úplnou kontrolou symptomů astmatu. Kromony by se neměly kombinovat s β2-dlouhodobě působící agonisté, protože užívání těchto léků bez IKS zvyšuje riziko úmrtí na astma.
IV. Anti-IgE léky
Jedná se o zcela novou třídu léků, které se dnes používají ke zlepšení kontroly těžkého perzistujícího atopického astmatu. Omalizumab je nejvíce prozkoumaným, prvním a jediným lékem doporučeným pro použití u dětí starších 12 let. Vysoké náklady na léčbu omalizumabem, stejně jako nutnost měsíčních návštěv lékaře kvůli injekčnímu podávání léku, jsou oprávněné u pacientů vyžadujících opakované hospitalizace, neodkladnou lékařskou péči a užívající vysoké dávky inhalačních a/nebo systémových kortikosteroidů.
V. Dlouhodobě působící methylxantiny
Theofylin je významně účinnější než placebo při kontrole astmatu a zlepšení plicních funkcí, a to i v dávkách pod obecně doporučovaným terapeutickým rozmezímA. Použití theofylinů k léčbě astmatu u dětí je však problematické kvůli možnosti závažných okamžitých (srdeční arytmie, smrt) a opožděných (poruchy chování, problémy s učením) vedlejších účinků. Proto je použití teofylinů možné pouze pod přísnou farmakodynamickou kontrolou.
VI. Dlouhodobě působící β2-agonisté Inhalační β2– dlouhodobě působící adrenergní agonisté
Léky z této skupiny jsou účinné při udržování kontroly astmatu (obr. 1). Průběžně se používají pouze v kombinaci s IKS a předepisují se pouze tehdy, když standardní počáteční dávky IKS neumožňují dosáhnout BA kontroly. Účinek těchto léků trvá 12 hodin. Formoterol ve formě inhalace uplatňuje svůj terapeutický účinek (uvolnění hladkého svalstva průdušek) do 3 minut, maximální účinek se rozvíjí za 30–60 minut po inhalaci. Salmeterol začíná působit relativně pomalu, významný účinek je zaznamenán 10–20 minut po inhalaci jednotlivé dávky (50 mcg) a účinek srovnatelný s účinkem po užití salbutamolu se rozvíjí po 30 minutách. Vzhledem k pomalému nástupu účinku by salmeterol neměl být předepisován ke zmírnění příznaků akutního astmatu. Protože se účinek formoterolu rozvíjí rychleji než účinek salmeterolu, umožňuje to použití formoterolu nejen k prevenci, ale také k úlevě od příznaků astmatu. Podle doporučení GINA 2006 však dlouhodobě působící β2-adrenergní agonisté lze použít pouze u pacientů, kteří již dostávají pravidelnou udržovací léčbu IKS.
Obrázek 1. Klasifikace β2-agonisté
Děti léčbu inhalačním β tolerují2– dlouhodobě působící adrenergní agonisté, a to i při dlouhodobém užívání, a jejich vedlejší účinky jsou srovnatelné s β2– krátkodobě působící adrenergní agonisté (pokud se používají na vyžádání). Léky této skupiny by měly být předepisovány pouze ve spojení se základní terapií IKS, protože monoterapie β2-dlouhodobě působící adrenergní agonisté bez IKS zvyšují pravděpodobnost úmrtí pacientů! Vzhledem k rozporuplným údajům o účinku na exacerbace astmatu nejsou tyto léky léky volby u pacientů vyžadujících dvě nebo více udržovacích terapií.
Orální β2– dlouhodobě působící adrenergní agonisté
Mezi léky této skupiny patří dlouhodobě působící lékové formy salbutamolu. Tyto léky mohou pomoci kontrolovat příznaky nočního astmatu. Mohou být použity jako doplněk k IKS, pokud IKS ve standardních dávkách neposkytují dostatečnou kontrolu nočních příznaků. Možné vedlejší účinky zahrnují kardiovaskulární stimulaci, úzkost a třes. U nás se léky této skupiny v pediatrii používají jen zřídka.
VII. Anticholinergní léky
Inhalační anticholinergika se nedoporučují k dlouhodobému užívání (základní terapii) u dětí s astmatem.
VIII. Systém GCS
I přes skutečnost, že systémové kortikosteroidy jsou účinné proti astmatu, je nutné počítat s rozvojem nežádoucích účinků při dlouhodobé terapii, jako je potlačení osy hypotalamus-hypofýza-nadledviny, zvýšení tělesné hmotnosti, steroidní diabetes, šedý zákal, hypertenze , růstová retardace, imunosuprese, osteoporóza, duševní poruchy . Vzhledem k riziku nežádoucích účinků při dlouhodobém užívání by měly být perorální kortikosteroidy podávány dětem s astmatem pouze v případech těžkých exacerbací, a to jak s virovou infekcí, tak bez ní.
NOUZOVÁ TERAPIE LÉKY
Inhalace β2-rychle působící adrenergní agonisté (krátkodobě působící β2-agonisté) jsou ze stávajících bronchodilatancií nejúčinnějšími léky volby pro léčbu akutního bronchospasmu A (obr. 1). Do této skupiny léků patří salbutamol, fenoterol a terbutalin (tab. 3).
Tabulka 3. Pohotovostní léky na astma
Účinnost a bezpečnost inhalačních glukokortikosteroidů
Glukokortikosteroidy jako hlavní léky pro léčbu astmatu. ICS.
Jak je známo, průběh bronchiálního astmatu (BA) je založen na chronickém zánětu a hlavní metodou léčby tohoto onemocnění je použití protizánětlivých léků. Dnes jsou glukokortikosteroidy uznávány jako hlavní léky pro léčbu astmatu.
Systémové kortikosteroidy zůstávají dnes léky první volby v léčbě exacerbace astmatu [1], ale koncem 60. let minulého století začala nová éra v léčbě astmatu a je spojena se vznikem a zavedením do klinické praxe. praktikování inhalačních glukokortikosteroidů (ICS).
IKS v léčbě pacientů s astmatem jsou v současnosti považovány za léky první volby [2–8]. Hlavní výhodou IKS je přímá dodávka účinné látky do dýchacích cest a vytvoření vyšších koncentrací léčiva tam při současném odstranění nebo minimalizaci systémových nežádoucích účinků. Prvními IKS pro léčbu astmatu byly aerosoly ve vodě rozpustného hydrokortizonu a prednisolonu. Pro jejich vysoké systémové a nízké protizánětlivé účinky však bylo jejich použití neúčinné [9]. Na počátku 1970. let XNUMX. století. byly syntetizovány lipofilní glukokortikosteroidy s vysokou lokální protizánětlivou aktivitou a slabým systémovým účinkem. IKS se tak v současnosti staly nejúčinnějšími léky pro základní léčbu BA u pacientů jakéhokoli věku (úroveň důkazu A).
IKS může snížit závažnost příznaků astmatu [2], potlačit aktivitu alergického zánětu [5, 7], snížit bronchiální hyperreaktivitu na alergeny a nespecifické dráždivé látky (fyzická aktivita, studený vzduch, škodliviny atd.), [6], zlepšit průchodnost průdušek [5, 7], zlepšit kvalitu života pacientů, snížit počet absencí ve škole a v práci [3]. Bylo prokázáno, že použití IKS u pacientů s astmatem vede k významnému snížení počtu exacerbací a hospitalizací, snižuje mortalitu na astma a také zabraňuje rozvoji ireverzibilních změn v dýchacích cestách (úroveň důkazu A) [1, 3, 9, 10, 11]. IKS se také úspěšně používají k léčbě CHOPN a alergické rýmy jako nejúčinnější léky s protizánětlivým účinkem [12,13, 14].
Na rozdíl od systémových glukokortikosteroidů se IKS vyznačují vysokou afinitou k receptorům, nižšími terapeutickými dávkami a minimálními vedlejšími účinky.
O nadřazenosti IKS v léčbě BA nad ostatními skupinami antiflogistik nelze pochybovat a dnes jsou podle většiny tuzemských i zahraničních odborníků IKS nejúčinnějšími léky pro léčbu pacientů s BA [1,3, 7, 8, 9, 10, 11]. Ale i v dobře prostudovaných oblastech medicíny existují nedostatečně podložené a někdy i mylné představy. Dodnes se vedou diskuse o tom, jak brzy je nutné léčbu IKS zahájit, v jakých dávkách, jaké IKS a jakým aplikačním zařízením, jak dlouhodobou terapii provádět a hlavně, jak si být jisti, že předepsaná IKS terapie nezpůsobuje poškození těla, ty. Kortikosteroidy nemají žádný systémový účinek ani jiné nežádoucí účinky. Medicína založená na důkazech je zaměřena právě na potírání takových trendů, existujících podle názoru lékařů i pacientů, které snižují účinnost léčby a prevence astmatu.
V klinické praxi se v současnosti používají tyto IKS: beklometason dipropionát (BDP), budesonid (BUD), flutikason propionát (FP), triamcinolon acetonid (TAA), flunisolid (FLU) a mometason furoát (MF). Účinnost terapie IKS přímo závisí na: účinné látce, dávce, formě a způsobu podání, komplianci. načasování zahájení léčby, délka terapie, závažnost (exacerbace) BA a také CHOPN [7, 8, 14].
Které ICS je účinnější?
Při ekvivalentních dávkách jsou všechny IKS stejně účinné (úroveň důkazu A) [2, 8, 9, 15, 16]. Farmakokinetika léčiv, a tedy terapeutická účinnost, je určena fyzikálně-chemickými vlastnostmi molekul GCS. Protože molekulární struktura IKS je odlišná, mají odlišnou farmakokinetiku a farmakodynamiku. Pro srovnání klinické účinnosti a možných nežádoucích účinků IKS se navrhuje použít terapeutický index, poměr pozitivních (žádoucích) klinických a vedlejších (nežádoucích) účinků, jinými slovy účinnost IKS se posuzuje podle jejich systémového působení. a lokální protizánětlivé působení. S vysokým terapeutickým indexem je lepší poměr efekt/riziko. Pro stanovení terapeutického indexu je důležitých mnoho farmakokinetických parametrů. Protizánětlivá (lokální) aktivita IKS je tedy dána následujícími vlastnostmi léků: lipofilita, která umožňuje jejich rychlejší a lepší vstřebávání z dýchacího traktu a delší setrvání v tkáních dýchacích orgánů; afinita k receptorům GCS; vysoký primární inaktivační účinek v játrech; trvání spojení s cílovými buňkami [9-11].
Jedním z nejdůležitějších ukazatelů je lipofilita, která koreluje s afinitou léku ke steroidním receptorům a jeho poločasem rozpadu. Čím vyšší je lipofilita, tím účinnější je lék, protože snadno proniká buněčnými membránami a zvyšuje jeho akumulaci v plicní tkáni. Tím se prodlužuje doba jeho působení obecně a lokální protizánětlivý účinek vytvořením rezervoáru léčiva.
Lipofilita je nejvýraznější u FP, následuje BDP a BUD. [17]. FP a MF jsou vysoce lipofilní sloučeniny, v důsledku toho mají větší distribuční objem ve srovnání s léky, které jsou méně lipofilní BUD, TAA. BUD je přibližně 6-8krát méně lipofilní než FP, a tedy 40krát méně lipofilní ve srovnání s BDP. Řada studií zároveň prokázala, že méně lipofilní BUD zůstává v plicní tkáni déle než AF a BDP. To je vysvětleno lipofilitou budesonidových konjugátů s mastnými kyselinami, která je desítkykrát vyšší než lipofilita intaktního BUD, což zajišťuje dobu jeho pobytu v tkáních dýchacího traktu [18–22]. Intracelulární esterifikace BUD mastnými kyselinami v tkáních dýchacího traktu vede k lokální retenci a tvorbě „depa“ neaktivního, ale pomalu se regenerujícího volného BUD. Navíc velký intracelulární přísun konjugovaného BUD a postupné uvolňování volného BUD z konjugované formy může prodloužit saturaci receptoru a protizánětlivou aktivitu BUD, a to i přes jeho nižší afinitu k receptoru GCS ve srovnání s FP a BDP [23].
FP má největší afinitu k receptorům GCS (přibližně 20krát vyšší než u dexametazonu, 1,5krát vyšší než u aktivního metabolitu BDP-17-BMP a 2krát vyšší než u BUD). Index afinity k receptorům je BUD – 235, BDP – 53, FP – 1800. Ale i přes skutečnost, že index afinity BDP je nejnižší, je vysoce účinný díky přeměně při vstupu do těla na monopropionát, který má index afinity 1400. To znamená, že nejaktivnější podle afinity k receptorům GCS jsou FP a BDP [24].
Jak je známo, účinnost léčiva se posuzuje podle jeho biologické dostupnosti. Biologická dostupnost IKS se skládá z biologické dostupnosti dávky absorbované z gastrointestinálního traktu a biologické dostupnosti dávky absorbované z plic [25].
Vysoké procento depozice léčiva v intrapulmonálním respiračním traktu normálně poskytuje lepší terapeutický index pro ty IKS, které mají nízkou systémovou biologickou dostupnost v důsledku absorpce ze sliznic ústní dutiny a gastrointestinálního traktu. Týká se to např. BDP, který má systémovou biologickou dostupnost díky střevní absorpci, na rozdíl od BUD, který má systémovou biologickou dostupnost především díky plicní absorpci [26]. U IKS s nulovou biologickou dostupností (AF) je účinnost léčby určena pouze typem zařízení pro podávání léčiva a inhalační technikou a tyto parametry nemají vliv na terapeutický index [27].
Pokud jde o metabolismus IKS, BDP je rychle, během 10 minut, metabolizován v játrech za vzniku jednoho aktivního metabolitu – 17BMP a dvou neaktivních – beklomethason 21-monopropionátu (21-BMN) a beklomethasonu. FP je rychle a úplně inaktivován v játrech za vzniku jednoho částečně aktivního (1 % aktivity FP) metabolitu – 17β-karboxylové kyseliny. Budesonid je rychle a úplně metabolizován v játrech za účasti cytochromu p450 3A (CYP3A) za vzniku 2 hlavních metabolitů: 6β-hydroxybudesonidu (tvoří oba izomery) a 16β-hydroxyprednisolonu (tvoří pouze 22R). Oba metabolity mají slabou farmakologickou aktivitu [7, 8].
Srovnání používaných IKS je obtížné vzhledem k rozdílům v jejich farmakokinetice a farmakodynamice. FP je lepší než ostatní IKS ve všech studovaných parametrech farmakokinetiky a farmakodynamiky. Výsledky nedávných studií ukazují, že FP je při stejných dávkách minimálně 2krát účinnější než BDP a BUD.
Nedávno byly publikovány výsledky metaanalýzy 14 srovnávacích klinických studií FS s BDP (7 studií) nebo BUD (7 studií)[2]. Ve všech 14 studiích byl FP podáván v poloviční (nebo nižší) dávce ve srovnání s BDP nebo BUD. Při srovnání účinnosti BDP (400/1600 mcg/den) s AF (200/800 mcg/den) autoři nenalezli signifikantní rozdíly v dynamice ranního maximálního výdechového průtoku (PEFR) u žádného ze 7 analyzované studie. Klinická účinnost, stejně jako hladiny kortizolu v séru ráno, se významně nelišily. Při srovnání účinnosti BUD (400/1600 mcg/den) s FP (200/800 mcg/den) se ukázalo, že AF statisticky významně zvyšuje PEFR výrazněji než BUD. Při použití nízkých dávek léků není mezi těmito léky žádný rozdíl z hlediska snížení hladiny kortizolu v séru ráno, nicméně při použití vyšších dávek léků bylo zjištěno, že AF má na tento ukazatel menší vliv. Výsledky metaanalýzy [2] tedy naznačují, že účinnost BDP a poloviční dávky FP jsou ekvivalentní, pokud jde o jejich účinek na PEFR a klinickou účinnost. FP v poloviční dávce je účinnější než BUD z hlediska účinku na PEFR. Tato data potvrzují farmakokinetické charakteristiky, relativní afinitu tří studovaných léčiv ke steroidním receptorům.
Klinické studie srovnávající účinnost IKS v podobě zlepšení symptomů a ukazatelů respiračních funkcí ukazují, že UD a BDP v aerosolových inhalátorech ve stejných dávkách se účinností prakticky neliší, FP poskytuje stejný efekt jako dvojnásobná dávka BDP resp. BUD v aerosolu s odměřenou dávkou.
Srovnávací klinická účinnost různých IKS je v současné době aktivně studována.
Выdávka boru IKS. Vypočítané doporučené nebo optimální? Která je účinnější? Významný zájem lékařů o volbu denní dávky IKS a délky léčby při provádění základní léčby astmatu za účelem kontroly symptomů astmatu. Lepší úrovně kontroly nad průběhem astmatu je dosaženo rychleji při použití vyšších dávek IKS (úroveň důkazu A, tabulka 1) [1, 2, 28,29].
Počáteční denní dávka IKS by měla být obvykle 400–1000 mcg (z hlediska beklometazonu u těžšího astmatu lze doporučit vyšší dávky IKS nebo zahájit léčbu systémovými kortikosteroidy (C) [28–31]. Standardní dávky IKS (ekvivalent 800 mcg beklometazonu), pokud jsou neúčinné, mohou být zvýšeny na 2000 mcg ve smyslu beklometazonu (A) [7].
Údaje o účincích souvisejících s dávkou, jako je AF, jsou smíšené. Někteří autoři tedy zaznamenávají na dávce závislé zvýšení farmakodynamických účinků tohoto léku [28, 30], zatímco jiní výzkumníci uvádějí, že použití nízkých (100 mcg/den) a vysokých dávek (1000 mcg/den) EP je téměř stejně efektivní [32, 33].
Tabulka 1. РVypočítané ekvivalentní dávky ICS (mcg) A.G. Chuchalin, 2002 upraveno
